Grupo de Biofotônica (GB)
- Início
- DEQ - Departamento de Eletrônica Quântica
- Grupo de Biofotônica (GB)
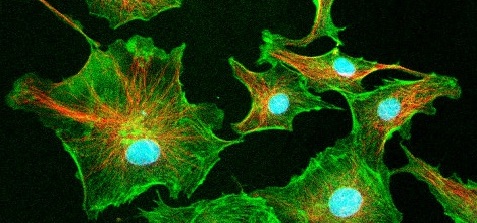
O Grupo pesquisa técnicas de microscopia em biofotônica – ou seja, microscopia em sistemas biológicos usando raios laser. A microscopia em biofotônica permite observações não-destrutivas das células (ou seja, em células vivas), a determinação de que substâncias compõem suas partes e a observação de processos fisiológicos em andamento. Além disso, pode-se, com os lasers (na forma de pinças laser), manipular diretamente pequenos elementos dentro das células – como mover um lipossomo ou pequenos cristais através do citoplasma –, mantendo-as vivas e sem feri-las. A imagem ao lado mostra células endoteliais bovinas e foi obtida com as técnicas do grupo.
A palavra biofotônica deriva de fotônica. Esta última expressão pode ser considerada análoga ao termo “eletrônica”, que se refere às tecnologias baseadas na manipulação de elétrons (ou seja, de correntes elétricas, tensões elétricas etc. em aparelhos elétricos e eletrônicos). Assim, a fotônica refere-se a tecnologias baseadas na manipualção de fótons, ou seja, de luz - como nas fibras ópticas e na microscopia a laser.
Já a biofotônica usa a fotônica para aplicações na biologia. Há basicamente duas vertentes: uma, ligada à terapia, que usa o laser para cirurgias, tirar manchas na pele, eliminar cicatrizes etc. A outra é a microscopia no nível celular, com a qual o Grupo trabalha.
A pinça óptica é uma técnica que permite manipular objetos do tamanho de células ou ainda menores, por meio de lasers. Ela aproveita o fato de que a luz é capaz de exercer força sobre um objeto na qual incide. Essas forças, em casos práticos usando pinças ópticas, podem chegar ao equivalente ao peso de uma massa de 0,1 picograma (0,1 x 10 -12 g) até 20 nanogramas (20 x 10 -9 g). Isso é próximo da ordem de grandeza da massa de um protozoário como a Leishmania, de modo que tais micróbios podem ser levemente afetados pela pressão do laser. Uma configuração adequada de lasers pode manter o microorganismo “preso”. Veja o vídeo abaixo, que mostra uma Leishmania amazonensis tentando escapar da pinça óptica, sem conseguir. Repare como outros micróbios passam perto dela, imunes ao efeito da pinça, que só age na pequena região onde ela está.
Leishmania amazonensis presa em uma pinça óptica.
É possível também manipular as estruturas microscópicas. Os dois vídeos abaixo ilustram um pouco do que pode ser feito. No da esquerda, uma cadeia de hemácias é esticada até se romper. No da direita, um lipossomo é movido através do citoplasma da célula, sem ferir a mesma. No final, o esforço acaba rompendo-o. Essas manipulações diretas podem ser instrumentos importantes nas pesquisas sobre as células.
Cadeia de hemácias grudadas uma na outra é esticada por uma pinça óptica até se romper. Clique na imagem para ver o vídeo.
Uma pinça óptica move um lipossomo através do citoplasma de uma célula, mantendo o citoplasma e a célula intactos. Clique na imagem para ver o vídeo.
Na microscopia, a óptica tradicional alcança no máximo 200 nm. Porém, há organelas celulares menores do que isso. Abaixo desse limiar, há uma lacuna nas possibilidades das técnicas modernas, pois os métodos disponíveis – como a microscopia eletrônica e a microscopia de força atômica - possuem limitações. Por exemplo, a microscopia eletrônica permite distinguir estruturas mil vezes menores, de até 0,2 nm, mas ela mata e destrói a célula observada. Já a de força atômica alcança dimensões menores que 200 nm sem matar a célula – mas não pode estudar o seu interior, só a superfície. Os métodos da biofotônica, por sua vez, podem superar as três limitações simultaneamente: (1) permitem estudar a célula viva, (2) permitem acesso ao seu interior e (3) alcançam dimensões menores que 200 nm.
O desafio agora é aperfeiçoar os métodos de modo a cobrir toda essa lacuna. Outro desafio é alcançar maior profundidade no material estudado.
As principais técnicas com que o Grupo está trabalhando atualmente nesse sentido são: a microscopia multifóton, a microscopia com segundo e terceiro harmônicos, a FLIM ( Flourescence Lifetime Imaging) e a CARS ( Coherent AntiStokes Raman Scattering, ou Espalhamento Raman Anti-Stokes Coerente).
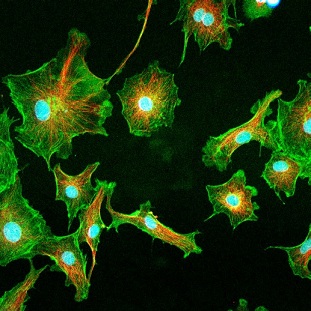
Células endoteliais bovinas obtidas com a espectroscopia multifóton.
Fonte: Dissertação de mestrado de André Alexandre de Thomaz, IFGW/Unicamp (2007), pág. 118.
Na microscopia multifóton, as moléculas absorvem mais de um fóton de cada vez. Uma das principais vantagens de se usar mais de um fóton é o aumento da capacidade de penetração do laser. Nas técnicas convencionais, pode-se alcançar uma profundidade de 150-200 micrômetros abaixo de sua superfície; com a espectroscopia mutifóton, a profundidade pode aumentar para mais de 700 micrômetros.
Para as moléculas absorverem mais de um fóton de cada vez, os fótons devem chegar praticamente ao mesmo tempo no mesmo ponto do espaço. Para se garantir isso, é preciso usar lasers pulsados de modo ultrarrápido, nos quais os pulsos se sucedem a cada 100 femtossegundos (1 fs = 10 -15 segundo).
Na microscopia com segundo e terceiro harmônico, o que se chama “harmônicos” são componentes da onda da luz análogos aos harmônicos do som. Em geral, o que se observa é o primeiro harmônico da luz; porém, informações importantes podem estar contidas nos outros – e assim, a microscopia com harmônicos maiores pode enriquecer a investigação com novos dados.
Os colágenos são notórios produtores de segundos harmônicos. O estudo dos colágenos é importante para se investigar, por exemplo, como se dá o processo de metástase do câncer. Para a célula cancerosa sair do foco principal do câncer e atingir outras regiões do corpo (causando assim a metástase), ela tem que atravessar fibras de colágeno que normalmente o corpo produz para englobar o foco canceroso. Com a espectroscopia com segundo harmônico, é possível, por exemplo, observar diretamente uma célula atravessando as fibras de colágeno.
Já o terceiro harmônico aparece comumente nas interfaces - nas junções entre diferentes partes da célula, feitas de diferentes substâncias. Assim, pode-se ver, com ele, uma rica estrutura celular, como se pode ver na figura abaixo.
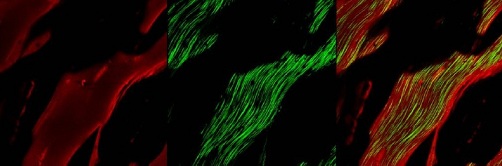
Imagem de tendão de rato com microscopia multifóton (à esquerda), com segundo harmônico (no centro) e a superposição das duas (à direita).
Fonte: Tese de mestrado de André Alexandre de Thomaz, IFGW/Unicamp (2007), pág. 120.
Na FLIM, o que se analisa é o tempo que a luz absorvida demora para ser reemitida. Esse tempo depende do ambiente químico onde a molécula está – ou seja, das substâncias químicas que se encontram na sua vizinhança. A FLIM é capaz, portanto, de fornecer informações sobre o ambiente químico, o que pode dar indicações, por exemplo, sobre o metabolismo celular e sobre processos cancerosos.
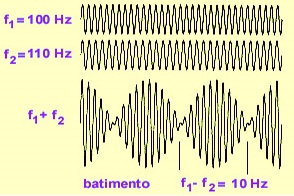
No CARS, usa-se dois lasers com frequências ligeiramente diferentes que, quando se juntam, produzem um batimento, ou seja, uma onda com intensidade variável (veja a figura ao lado: as ondas se somam e se cancelam alternadamente por causa da diferença de frequência). Acontece que a frequência do batimento é capaz de interagir com a frequência de vibração dos núcleos das moléculas. Assim, uma análise do batimento da luz que emerge da célula permite determinar o conjunto das vibrações nucleares (ou seja, fazer uma espectroscopia dessas vibrações), o que permite, por sua vez, determinar a composição química da célula. Na verdade, o que esse método faz, em última análise, é aumentar muito (em torno de um fator 10 7) a sensibilidade de outra técnica, a espectroscopia Raman, na qual se observa a mudança de frequência do fóton reemitido em relação ao absorvido.
O desafio atual para o Grupo é integrar diversas técnicas de microscopia e análise de espectro para que se possa extrair o máximo possível de informações da célula (cada técnica é capaz de extrair certo tipo de informação).
Universidade Estadual de Campinas - Instituto de Física Gleb Wataghin
Rua Sérgio Buarque de Holanda, 777
Cidade Universitária, Campinas - SP, 13083-859
Fone +55 19 3521-5297
Fax +55 19 3521-4147