Grupo de Física Estatística de Fluidos Complexos (GFEFC)
- Início
- A Instituição
- Departamentos
- DFA - Departamento de Física Aplicada
- Grupo de Física Estatística de Fluidos Complexos (GFEFC)
Fluido é um termo genérico para se falar do que não é sólido – ou seja, líquidos e gases. Embora não haja uma definição precisa e universalmente aceita, os fluidos ditos complexos possuem propriedades físicas e químicas peculiares, mais complexas que as dos fluidos normais. Exemplos do nosso cotidiano são várias tintas (cuja propriedade diferente da dos fluidos normais é, por exemplo, escorrer muito pouco quando aplicadas sobre uma superfície, o que permite a sua adesão e posterior solidificação), a cola (que “cola”), o cristal líquido (cujas moléculas são capazes de ordenar-se parcialmente e que podem ser usadas para formar imagens, como na tela de um computador ou de TV), a espuma de barbear, o xampu, a maionese, o detergente, o iogurte, vários fluidos biológicos como o sangue, o leite e mesmo a água sob determinadas condições.

Há várias propriedades e fenômenos pouco compreendidos sobre esses fluidos. Por isso, são importantes os estudos experimentais e teóricos. O Grupo de Fluidos Complexos faz pesquisas teóricas, procurando compreender melhor suas propriedades, por que eles se comportam dessa forma e, em princípio, a partir deste conhecimento, como desenvolver novos fluidos com propriedades pré-determinadas.
A água, apesar de comum e, por isso mesmo, parecer muito simples, pode ser também considerada um fluido complexo, pois suas moléculas associam-se em pequenos conjuntos chamados “clusters” (aglomerados). As moléculas de água se mantém próximas por ligações chamadas “pontes de hidrogênio” (veja a figura). Estas ligações têm duração muito curta e os clusters não são estáveis, mas ficam formando-se e desmanchando-se continuamente. No entanto, devido à rede de pontes de hidrogênio, do ponto de vista estrutural a água se parece mais como um gel. Uma das propriedades anômalas da água é o fato de sua fase sólida em baixas temperaturas – que chamamos de gelo – ser menos densa do que a fase líquida. Usualmente, ocorre o oposto, isto é, o sólido é em geral mais denso do que o líquido. É por este motivo que um cubo de gelo flutua num copo d'água. Esta propriedade, aliás, é essencial para garantir a existência de vida em climas mais frios, pois, por exemplo, permite a um peixe sobreviver ao inverno!
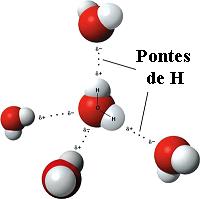
Fonte: Wikipedia
A complexidade desses fluidos pode surgir por diversas razões. Ocorre, por exemplo, naqueles compostos de moléculas muito grandes (macromoléculas), que são constituídas por centenas ou milhares de átomos. Exemplos são os fluidos biológicos, que contêm agregados supramoleculares (proteínas, micelas, vesículas etc.) imersos em água. As propriedades do fluido dependem da forma das macromoléculas e de como elas interagem entre si e com a água. Dependendo das condições físico-químicas da solução aquosa em que estão imersos, a forma dos agregados ou a sua interação mútua pode sofrer alteração, modificando, consequentemente, as propriedades macroscópicas do fluido.
Outra situação aparece quando diferentes estados físicos (sólido, líquido e gasoso) coexistem microscopicamente no fluido, caso genericamente chamado de suspensão coloidal. Por exemplo, partes sólidas e gasosas podem coexistir na fumaça (que consiste em partículas sólidas microscópicas dispersas no ar). O conjunto gás mais partículas sólidas é, nesse caso, considerado um fluido (apesar das partículas serem sólidas), pois ele se comporta como tal. Outro exemplo: partes gasosa e líquida aparecem em espumas muito finas; partes sólida e líquida aparecem em gelatinas; partes líquidas e gasosa também aparecem em aerosóis – só que, ao contrário das espumas finas, desta vez é a parte gasosa que é contínua e a líquida que é distribuída em gotículas microscópicas. O leite pode ser considerado uma emulsão, em que proteínas, gotículas de óleo e outras substâncias são misturadas à água.
As atividades do grupo de pesquisa se concentram principalmente na investigação do papel das cargas na determinação das propriedades de fluidos complexos iônicos, assim chamados por conterem cargas livres (íons). O grupo deseja saber, por exemplo, como se distribuem as cargas e como essa distribuição define e altera as propriedades termodinâmicas macroscópicas e mesoscópicas (isto é, entre as escalas microscópica e macroscópica).
Uma suspensão coloidal nada mais é do que uma mistura na qual o menor componente (chamado soluto) aparece em partículas tão pequenas que o conjunto parece macroscopicamente homogêneo, mas ainda assim não há dissolução completa no maior componente (chamado solvente). Exemplos, já comentados anteriormente, incluem: o leite, a maionese, a fumaça, a gelatina, a geléia, o iogurte.
Numa suspensão coloidal iônica, em geral as partículas de soluto adquirem cargas elétricas apenas em sua superfície, na interface soluto-solvente. Por exemplo, a maioria das proteínas contém grupos funcionais carregados em sua superfície (tanto positivos, como negativos), localizados em posições específicas para que a proteína desempenhe sua função biológica corretamente. Algumas doenças são causadas por mutações que modificam a distribuição de carga da proteína normal, fazendo com que ela altere ou perca sua função, ou até mesmo desestabilizando a sua estrutura, que foi convenientemente moldada ao longo da seleção natural. Além de razões específicas para cada proteína, de forma mais geral as cargas em sua superfície impedem que elas sofram colapso, pois, caso as proteínas fossem completamente neutras, tenderiam a se aglutinar, ocorrendo posterior precipitação.
As cargas na superfície de proteínas podem também ser neutralizadas alterando-se a acidez (pH) do meio aquoso, aumentando ou diminuindo a concentração de íons H+ na solução. Isso acontece, por exemplo, quando adicionamos vinagre ou suco de limão ao leite, coalhando-o. Ao aumentarmos a acidez do leite, suas proteínas se desestabilizam e se precipitam, formando o coalho.
Outra forma de desestabilizar proteínas, mas que não envolve as cargas elétricas, é através da temperatura, cujo exemplo familiar é o ovo cozido. Mas também podemos “cozinhar” um ovo misturando-o a vinagre ou suco de limão. Da mesma forma que a alteração de temperatura provoca a desestabilização da albumina (principal proteína da clara do ovo), a mudança de acidez também a desestabiliza. Experimente deixar um ovo cru imerso num copo de vinagre para ver o que acontece!
Também nas tintas, compostas por partículas sólidas microscópicas suspensas em água – por isso elas se solidificam quando secam –, podemos estabilizar a suspensão introduzindo cargas na superfície das partículas de soluto. A importância do estudo dos fluidos complexos é fácil de se compreender nesse caso das tintas, pois elas precisam ser estáveis, isto é, a sua parte sólida não pode se separar espontaneamente de sua parte líquida dentro da lata, mesmo sofrendo a ação da força gravitacional sobre as partículas sólidas. A introdução de cargas elétricas na superfície das partículas impede justamente que essa separação aconteça.
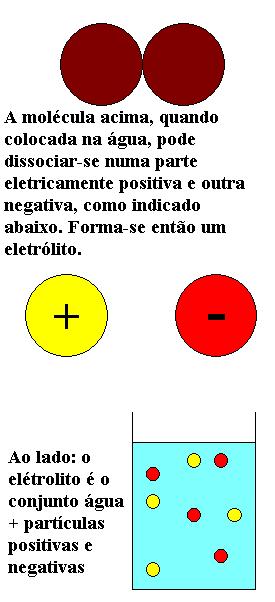
Eletrólitos são misturas de uma substância dissolvida em outra (soluto dissolvido em solvente) nas quais o soluto separa-se em partículas menores de cargas opostas quando imerso no solvente, como na figura ao lado (dizemos que ele se dissocia). Assim, o conjunto se torna condutor de eletricidade. Polieletrólitos são eletrólitos no qual um dos componentes do soluto é, em geral, um polímero iônico, contendo um número grande de cargas de mesmo sinal. Por sua vez, os polímeros (que podem ser iônicos ou não), são cadeias constituídas por grandes sequências de átomos ou moléculas, chamadas de monômeros. São iônicos quando os seus monômeros puderem se dissociar, tornando-se carregados.
Por exemplo, o DNA, responsável pelo armazenamento e transmissão da informação genética e o RNA, responsável pela síntese protéica, são exemplos de polinucleotídios (ou seja, nesse caso o monômero é uma molécula chamada nucleotídio). Tanto o DNA como o RNA são polieletrólitos, pelo fato de seus monômeros constituintes conterem um grupo fosfato que se torna negativamente carregado em solução aquosa. Já as proteínas são polipeptídios com centenas, milhares ou milhões de aminoácidos, alguns deles podendo ser dissociados. Mas, em geral, uma proteína contém tanto grupos de carga positiva como negativa. Por isso não representa um polieletrólito, mas é classificada como umpolianfólito.
Além de desempenharem papel fundamental em sistemas biológicos, os polieletrólitos possuem inúmeras aplicações práticas. Um exemplo são as fraldas descartáveis, cujo componente responsável pela absorção e retenção da água é um polieletrólito. Quando o polieletrólito da fralda está seco, fica bem compacto, mas quando entra em contato com a água, absorve-a, se tornando carregado (perdendo íons de sinal oposto para a água, os chamados contraíons) e se torna um gel de volume bem maior. A fralda então incha, o que é apropriado para a sua finalidade, pois retém a água absorvida. Ou seja, o gel não se comporta como uma esponja, em que a água pode ser facilmente removida por pressão mecânica. A atração eletrostática entre as cargas do polieletrólito e os íons dissolvidos na água, por possuírem cargas de sinais opostos, impedem que isso aconteça.

Micela
Fonte: Wikipedia
Uma das linhas de pesquisa do grupo envolve fosfolipídios iônicos. Fosfolipídios são os principais componentes das membranas celulares. São ditos iônicos quando se dissociam em solução aquosa e acumulam cargas elétricas em sua superfície. As moléculas individuais dos fosfolipídios têm uma particularidade: possuem uma região que tende a repelir as moléculas de água e outra que as atrai (são ditas, por isso, moléculas anfifílicas ou anfipáticas). Devido a estas propriedades conflitantes, as moléculas anfifílicas tendem espontaneamente a se autoagregar, por exemplo, como na micela (nome dado a esta estrutura) representada na figura ao lado, extraída do Wikipedia. Na ilustração, a parte da molécula que atrai a água é representada por uma esfera branca (chamada cabeça polar hidrofílica) e a outra (voltada para dentro da micela), por filetes amarelos (chamada de cauda hidrofóbica).
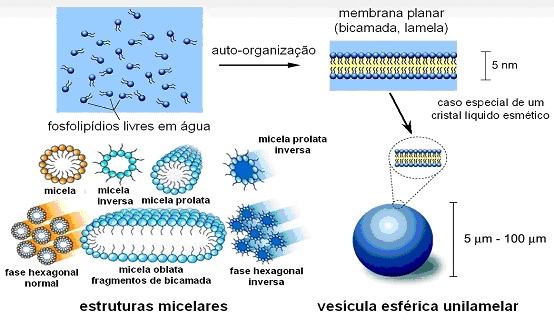
Transições de fase da Micela
Acontece que, nesses sistemas podem acontecer transições de fase nos agregados supramoleculares, o que altera, por exemplo, a sua forma, conforme mostra a figura acima. Transições de fase estão associadas a bruscas alterações estruturais em resposta à variação de parâmetros como a temperatura, acidez, presença de outros solutos (por exemplo, sal) etc. Exemplos de transição de fase na água são a passagem do sólido (gelo) para o líquido e do líquido para o gasoso (vapor d´água) pelo aumento da temperatura ou diminuição da pressão, em que a densidade do sistema se altera de forma descontínua.
Aliás, já neste sistema “simples” constituído somente pela água, podemos exemplificar o efeito da adição de sal na transição de fase. Em países de inverno mais rigoroso, é comum jogar sal sobre a neve para que ela derreta. Isso acontece porque a temperatura da transição de fase sólido/líquido da mistura água/sal é menor do que a da água pura, que ocorre a 0°C.
No caso dos fosfolipídios, podemos falar de transições de fase estruturais: por exemplo, se numa temperatura as micelas são esféricas, variando-se a temperatura elas podem subitamente ficar mais alongadas, como charutos, ou então com forma de discos, ou ainda diversos destes charutos podem se alinhar formando uma estrutura maior. A esta diversidade de formas possíveis se dá o nome de polimorfismo.
Outros tipos de transição, mais simples, ocorrem quando as caudas hidrofóbicas passam de uma fase mais ordenada para outra desordenada (chamada transição gel-líquido de lipídios) ou quando as cabeças polares iônicas readsorvem os contraíons inicialmente liberados na água. Há diversas questões ainda não compreendidas nestes sistemas, cuja dificuldade de tratamento teórico é agravada devido à presença das cargas em sistemas iônicos.
Os sistemas biológicos reais são muito complicados para permitirem uma compreensão global e, ao mesmo tempo, detalhada em termos físicos. Por isso, o grupo investiga sistemas simplificados (sistemas-modelo). Por exemplo, em membranas celulares, há diversos tipos de fosfolipídios, além de proteínas e outros tipos de moléculas. No entanto, estudam-se membranas-modelo constituídas de somente um tipo de lipídio, para tentar caracterizar suas propriedades isoladamente, no espírito do reducionismo físico. Ou seja, o grupo considera os chamados “sistemas biomiméticos”: que imitam sistemas biológicos – não são realmente biológicos, mas representariam um estudo em nível mais fundamental da realidade biológica. Este estudo compartimentalizado tem relevância no estudo da biologia propriamente dita, pois pode preencher lacunas no conhecimento que existem por causa da complexidade dos sistemas biológicos, que torna proibitivo seu estudo detalhado.
O grupo faz estudos teóricos sobre alguns desses tipos de fluidos mencionados, empregando métodos da física estatística de equilíbrio. A física estatística é um ramo da física que investiga sistemas constituídos por um número grande de elementos interagentes, estabelecendo uma ponte entre o mundo microscópico e o mundo macroscópico, este acessível a medidas. Por exemplo, um dos casos mais conhecidos dessa área é a determinação das propriedades macroscópicas de um gás a partir do movimento microscópico aleatório de suas moléculas (os “elementos”) que o constituem. É impossível descrever o movimento simultâneo de todas as moléculas de um gás contido numa garrafa, mas a partir de hipóteses gerais e modelos simplificados, podemos descrever algumas de suas propriedades.
Os estudos do grupo usam os modelos idealizados e métodos da física estatística para tentar descrever o que acontece nos fluidos complexos. O comportamento emergente dos modelos pode fornecer dicas importantes sobre os mecanismos microscópicos que produzem, por exemplo, as associações e ordenamentos das moléculas e outras complexidades.
As investigações teóricas consistem em propor modelos termoestatísticos simplificados visando a compreensão das propriedades dos fluidos complexos, com particular interesse em suas transições de fase. Dentre as propriedades investigadas teoricamente que podem também ser medidas experimentalmente estão, por exemplo, a condutividade (facilidade com que conduz a corrente elétrica) da solução de um fluido complexo iônico. Pode-se analisar como ela se altera através de variações da temperatura, acidez (pH), adição de sal etc. Resultados teóricos podem, então, ser comparados a estas medidas experimentais para verificar a validade da descrição do sistema real pelo modelo teórico ou a necessidade de se introduzir outros efeitos não incorporados inicialmente no modelo.
O grupo surgiu no fim de 2005, quando Mário Tamashiro foi contratado pela Unicamp, vindo do Instituto de Física da Universidade de São Paulo (IF-USP), tendo sido também pós-doutor em outras instituições no Brasil (IF-UFRGS) e no exterior (UC-Santa Barbara, EUA e MPIP-Mainz, Alemanha). Desde então, vêm sendo feitas pesquisas sobre os fluidos complexos com ênfase nas soluções coloidais iônicas, polieletrólitos e sistemas biomiméticos. As pesquisas com agregados de moléculas anfifílicas, como os fosfolipídios, são uma continuação da participação em projeto de pesquisa temático que vem já desde 2003, iniciado como pós-doutor. A partir de 2007, foi criado um projeto para o estudo, por meio da física estatística, das transições de fases em suspensões de lipídios iônicos. Mais recentemente tem-se investigado a distribuição de íons em interfaces dielétricas, por exemplo, na interface água-ar.
Universidade Estadual de Campinas - Instituto de Física Gleb Wataghin
Rua Sérgio Buarque de Holanda, 777
Cidade Universitária, Campinas - SP, 13083-859
Fone +55 19 3521-5297
Fax +55 19 3521-4147